

07.25 2025
组织者作为神经发育的导向标,负责调控神经组织的空间模式,并引导轴突长距离投射至其靶标。底板(Floor plate, FP)组织者位于神经管腹侧中线,由特化的神经上皮细胞构成。这些细胞沿背腹轴梯度分泌形态发生素和轴突导向信号,驱动脊髓的模式形成和中线轴突交叉,从而建立控制运动和感觉功能的双侧神经连接。
尽管非人类模型提供了基础性见解,但人类中线发育中组织者的保守性及其潜在功能差异仍知之甚少。组装体(Assembloids)是类器官(organoids)技术的进阶形态,指通过组合多种功能化类器官或细胞类型形成的三维生物结构,旨在模拟更复杂的人体组织结构和功能互作。利用这些新兴技术构建开发新的人类模型将有望揭示轴突导向机制以及与神经发育障碍相关的通路。
本月初,斯坦福大学Sergiu P. Pașca团队在《Science》期刊发表的研究“Midline assembloids reveal regulators of human axon guidance”,利用人类底板类器官(hFpOs)与脊髓类器官(hSpOs)构建的中线组装体(hMAs),首次在体外重现了人类神经管腹侧中线发育过程,并通过组学分析和阵列式CRISPR筛选鉴定出GALNT2和PLD3两个人类特异性轴突导向调控因子,为未来研究神经发育障碍研究提供了新靶点。

研究核心概述
1、人底板类器官(hFpOs) 和人脊髓类器官(hSpOs)的构建
研究者通过脊索信号模拟策略,将人诱导多能干细胞(hiPS)分化为人底板类器官(hFpOs)和人脊髓类器官(hSpOs)。hFpOs高表达腹侧标志物(FOXA2、SHH、NTN1),并形成玫瑰花结样结构;hSpOs则维持背侧特征(高表达PAX6/PAX3)。分泌组分析揭示NTN1为主动分泌蛋白,其介导的轴突导向功能通过小鼠脊髓外植体验证。单细胞转录组证实hFpOs细胞高度同质化,且与胚胎腹侧FP/p3区域高度匹配,证明该体系可稳定模拟早期人类底板发育。
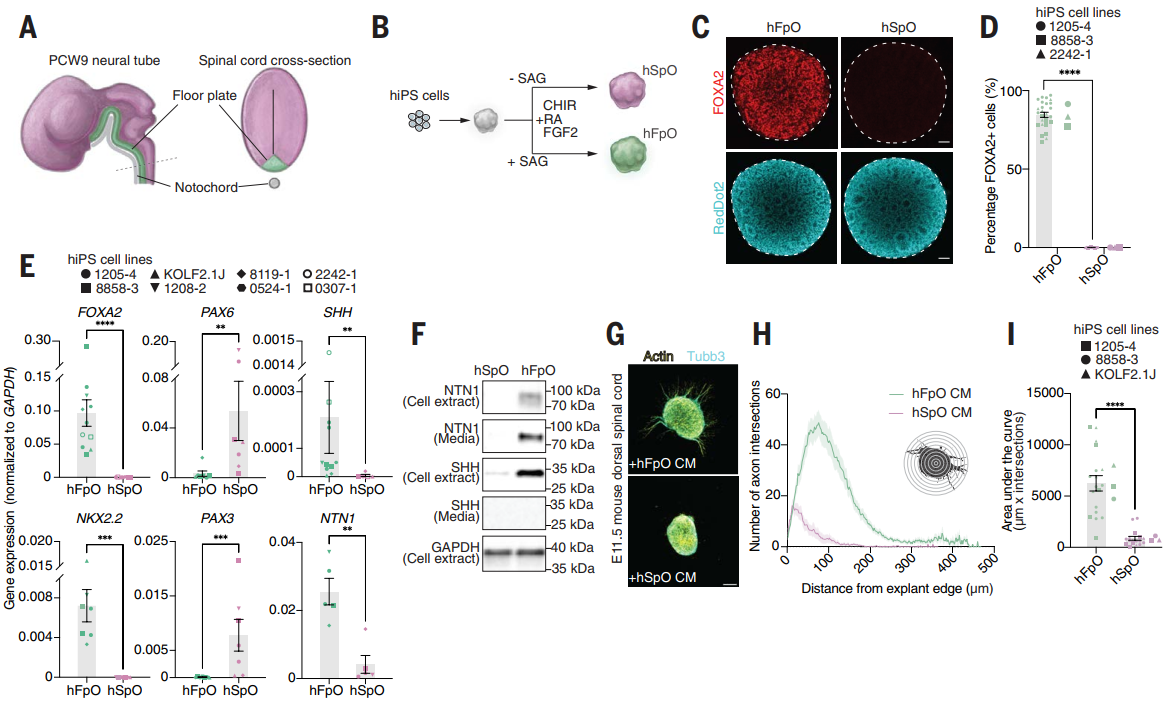
图1:利用人诱导多能干细胞诱导构建人底板类器官和脊髓类器官
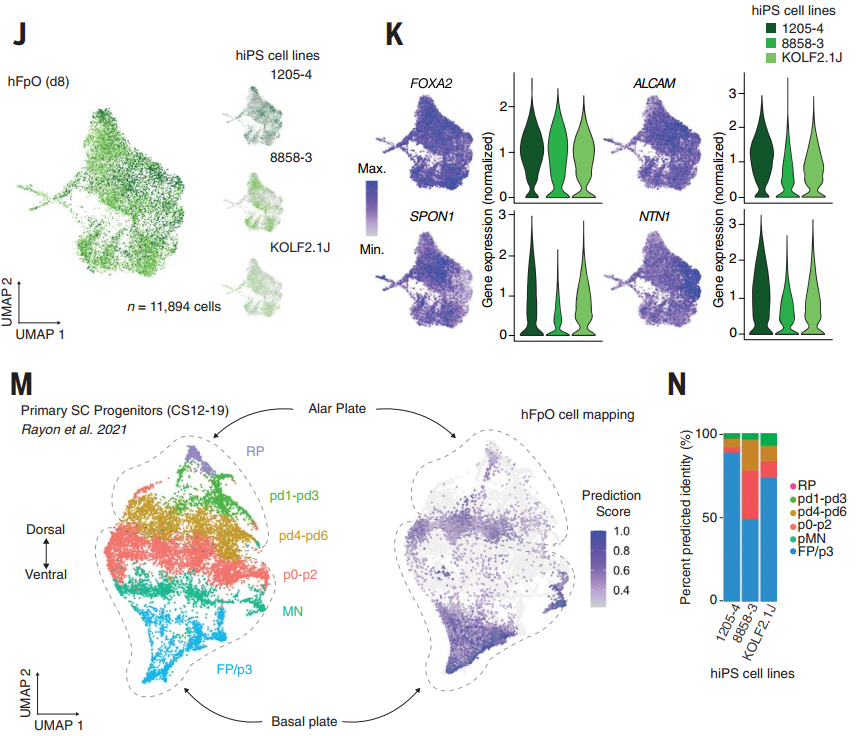
图2:单细胞转录组解析细胞身份
2、中线组装体(hMAs)模拟腹侧模式化的生成与验证
研究团队通过将荧光标记的hFpOs(人底板类器官)与无荧光标记的hSpOs(人脊髓类器官)在超低吸附圆底孔板中组装,构建中线组装体(hMAs),以模拟底板(FP)对脊髓腹侧模式化的调控作用。组装后观察到hFpO-hSpO交界处腹侧转录因子(FOXA2、NKX2.2、NKX6.1)的梯度表达,证实FP可诱导脊髓腹侧化。通过SHH抑制剂环巴胺(cyclopamine)处理和CRISPR靶向敲除hSpOs的SMO基因,验证腹侧化依赖SHH信号通路。单细胞转录组分析进一步显示:未组装的hSpOs表达背侧因子(LMX1A、PAX7、PAX3),而组装的hSpOs则转向腹侧命运(高表达NKX6.2、OLIG2、NKX2.2、FOXA2),证明hFpOs具有组织者样特性,可驱动脊髓类器官的腹侧特化。
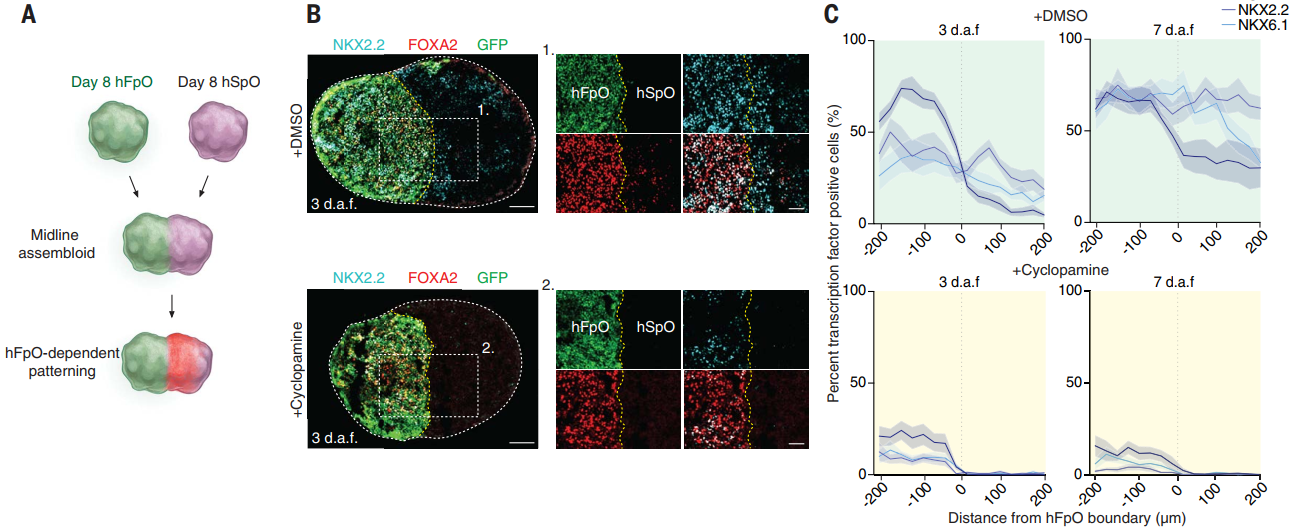
图3:hFpO-hSpO边界出现FOXA2、NKX2.2、NKX6.1的梯度表达,并受SHH信号通路调控
3、中线组装体(hMAs)模拟轴突导向的生成与验证
研究团队在人脊髓类器官(hSpOs) 中验证了脊髓连合神经元(commissural neurons)的存在,单细胞测序显示其表达ROBO3、CNTN2等特异性标志物及Netrin受体DCC。通过将第22天的hSpOs与第8天的人底板类器官(hFpOs)组装,观察到ROBO3+轴突向hFpOs的定向投射与成束现象,而对照组(hSpOs与无FP细胞的类器官组装)仅出现分散的轴突。量化分析证实轴突导向显著偏向hFpOs,证明其依赖FP分泌的导向信号(如Netrin-1)。
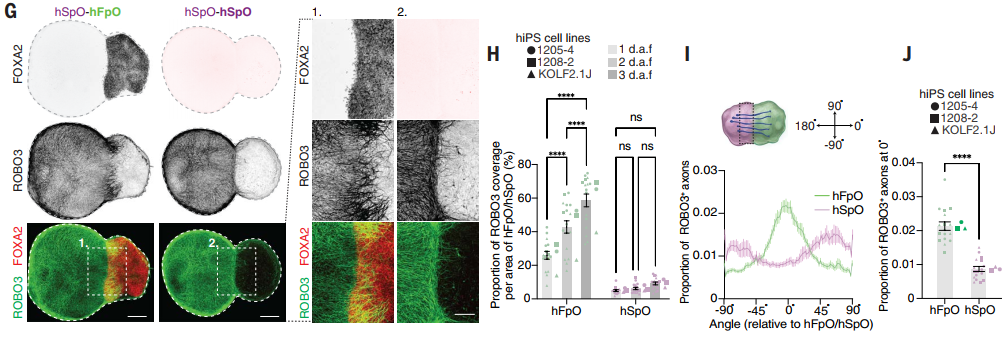
图4:ROBO3+轴突显著偏向底板类器官
4、三元中线组装体(three-part hMAs)构建与轴突跨越验证
研究团队构建了三元中线组装体(three-part hMAs),通过将第22天的两个脊髓类器官(hSpOs) 与第8天的底板类器官(hFpO) 组装成“hSpO-hFpO-hSpO”结构,成功模拟了连合轴突跨越中线及建立双侧功能连接的过程。实验组中,标记eYFP的轴突可穿透hFpO区域并延伸至对侧hSpO,而对照组(无FP细胞)几乎无轴突跨越。钙成像与光遗传学验证显示,含hFpO的组装体双侧神经元活动高度同步,且谷氨酸能突触传递介导了功能性连接。
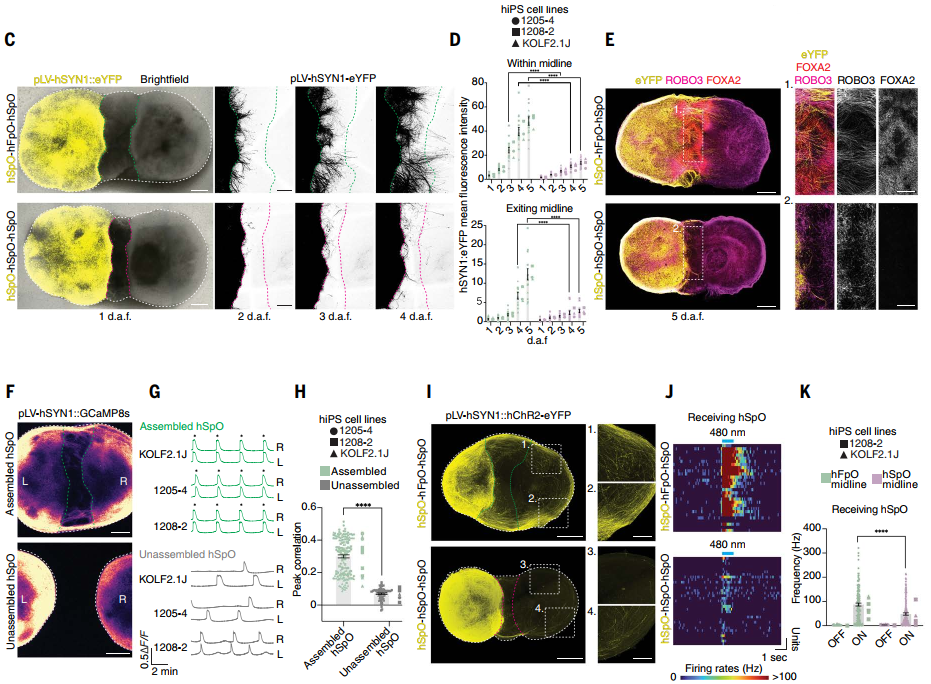
图5:中线组装体轴突功能性连接
研究团队利用阵列式CRISPR筛选技术,结合人底板类器官(hFpOs) 与脊髓类器官(hSpOs) 构建的中线组装体(hMAs),系统研究了27种人类富集膜蛋白/分泌蛋白在连合轴突导向中的作用。实验发现:敲除已知轴突导向因子NTN1和SPON1显著减少轴突投射,而NRP2敲除无影响(与啮齿类模型相反);而人类特异性富集的基因GALNT2(介导O-糖基化)和PLD3(磷脂水解酶)缺失会损害底板依赖的轴突导向;不同的是,GALNT2敲除降低FOXA2表达,影响底板特化,而PLD3敲除不改变底板身份但削弱轴突导向功能。
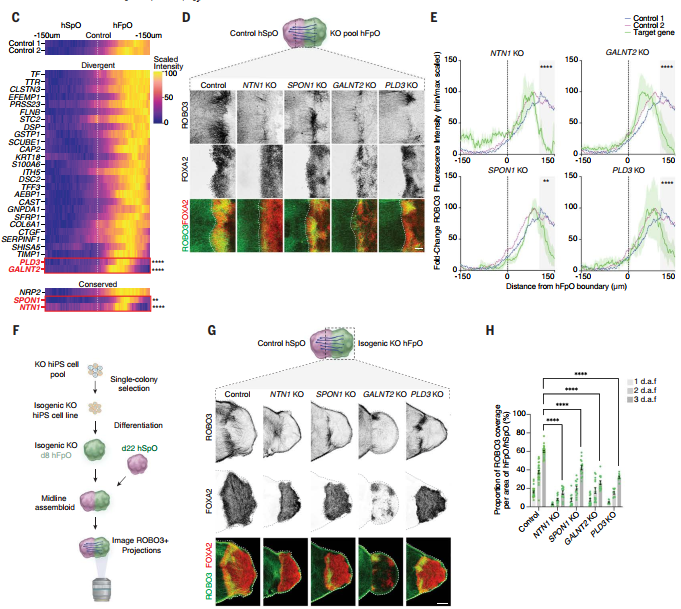
图6:阵列式CRISPR筛选人特异性轴突调控基因
研究创新
该研究通过组装底板类器官(hFpOs) 与脊髓类器官(hSpOs),构建中线组装体(hMAs),首次在体外模拟人类神经管腹侧中线发育的全过程,包括腹侧模式化、轴突导向及双侧神经连接,填补了人类神经发育模型空白。并借助CRISPR阵列筛选揭示了进化中人类特异的FP调控网络(如GALNT2/PLD3),为理解人脑复杂性提供新视角。未来需通过多组织者整合(如Wnt梯度生成类器官)和长效培养优化,推动其在神经发育疾病机制解析与药物筛选中的应用。
丹望医疗在人脑类器官研究中已尝试通过病毒定向单侧标记→组装→跨边界追踪,明确了类器官组装体间的结构性神经连接,为研究发育性神经环路提供了标准化方案。
我们使用AAV9-hSyn-mCherry病毒预标记一个类脑,特异性标记的神经元呈现mCherry+荧光信号,定位于胞体;将标记的皮层类器官与未标记类脑融合培养,经过10天静态培养,形成类脑组装体,明场可见连接处结构;mCherry⁺细胞跨越至另一类器官内部。
目前,相关研究正加急开展,最新研发进度请持续关注丹望医疗公众号!


