

NEWS
公司动态

 2025
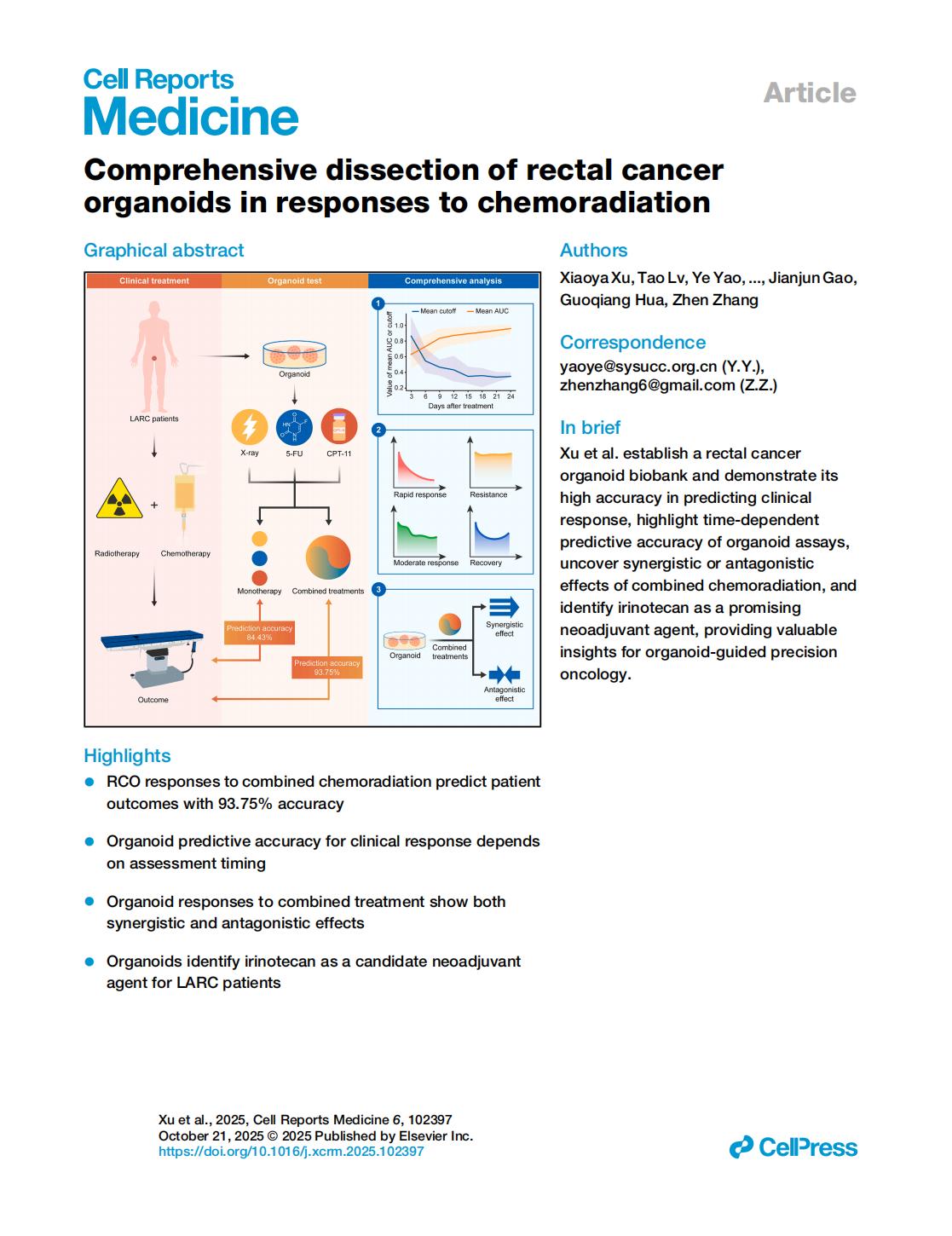
20252025年10月3日,复旦大学附属肿瘤医院章真教授、华国强研究员(丹望医疗创始人),及中山大学肿瘤防治中心姚晔等人在Cell子刊Cell Reports Medicine(IF:11.7)上发表了题为:Comprehensive dissection of rectal cancer organoids in responses to chemoradiation 的研究成果,揭示直肠癌患者来源类器官(RCO)模型对联合放化疗的反应可实现对临床治疗结局的高效预测,准确率突破93.75%,并鉴定出伊立替康可作为局部晚期直肠癌(LARC)患者新辅助治疗的候选药物,为局部晚期直肠癌(LARC)的个体化治疗方案制定提供了创新性技术支撑。
研究亮点:
1.直肠癌类器官(RCO)对联合放化疗的反应可预测患者临床结局,准确率高达93.75%;
2.类器官预测临床反应的准确性取决于评估时间节点的选择;
3.类器官对联合治疗的反应同时存在协同与拮抗效应;
4.类器官筛选出伊立替康作为局部晚期直肠癌(LARC)患者新辅助治疗的候选药物。
原文链接:https://doi.org/10.1016/j.xcrm.2025.102397

 2015
2015该研究成功建立20个结直肠癌病人的肿瘤组织类器官,并证实肿瘤类器官高度还原了原发肿瘤亚型,基因组变化等特性。肿瘤类器官适用于高通量药物筛选,可用于检测基因-药物关联。阐明类器官技术可以填补癌症遗传学和患者试验之间的空白,并可应用于设计个性化治疗方案。

 2022
2022首次报道了来源于结直肠癌肝转移(CRLM)患者原发灶及配对肝转移灶的类器官生物库,并从组织病理学、基因组学、转录组学和单细胞测序等多组学维度分析了该生物库的特征,对类器官生物库队列做出了重要补充;同时还评估了CRLM类器官预测化疗反应和临床预后的有效性,为CRLM来源类器官预测联合药物化疗(FOLFOX/FOLFIRI)提供了进一步的证据支持。

 2019
20192019年,丹望团队在国际顶级杂志《Cell Stem Cell》发表研究,是首个最大的具有统计学意义的肠癌类器官临床试验,探究了肿瘤类器官PDO模型对直肠癌新辅助化疗疗效预测的价值,预测精确度84.43%,敏感性78.01%,特异性91.97%.

 2016
2016该研究表明内源Wnt3定位于肠隐窝基底外侧质膜上。Wnt3由潘氏细胞产生,其转移需要潘氏细胞和干细胞的直接接触。通过操纵Wnt3分泌和阻止干细胞增殖,表明Wnt3主要通过细胞分裂产生的细胞结合转移。揭示了干细胞膜构成了Wnt蛋白的储存库,并操纵卷曲受体和细胞分裂产生的“质膜稀释” 形成Wnt3 梯度。

 2011
2011该研究利用CRISPR/Cas9技术,将人源肠道干细胞中最常见的四种结直肠癌突变基因(APC、P53、KRAS 和 SMAD4)进行修饰。突变类器官可以通过去除培养基中单一生长因子来筛选。四重突变体的生长并不需要Niche因子,并可以耐受P53稳定剂nutlin-3。将四重突变体异种移植到小鼠体内后,可生长为具有浸润特征的肿瘤。此外,APC和P53的联合缺失便足以出现肿瘤进展的标志,即产生大量非整倍体。

 2011
2011该研究发现小鼠肠道中条件性缺失Lgr5和Lgr4,会损害Wnt靶基因表达,并导致肠隐窝快速死亡,表现为Wnt通路抑制。质谱结果表明Lgr4和Lgr5与Frizzled/Lrp Wnt受体复合物相关。在HEK293细胞中,RSPO1会增强由WNT3A启动的经典WNT信号。去除LGR4并不影响 WNT3A信号传导,但会消除RSPO1介导的信号增强。这种现象可以通过重新表达LGR4,-5或-6进行拯救。小鼠肠道隐窝遗传缺失Lgr4/5模拟Rspo1缺失表型,并且可以通过激活Wnt通路来拯救。这些结果可以用于指导R-spondins应用于那些表达Lgr5同源物的组织的再生研究。

 2011
2011该研究探索了人乳腺上皮类器官的培养条件,并成功建立超过100例的原发及转移性乳腺癌类器官。乳腺癌类器官重构了原始肿瘤的组织学和遗传特征。此外,该研究表明肿瘤类器官可用于高通量药物筛选,且在肿瘤个性化治疗上具有极大的潜力。

 2011
2011该研究发现小鼠Lgr5干细胞与潘氏细胞之间存在密切联系。潘氏细胞表达培养和维持干细胞所必须的信号因子EGF, TGF-α, Wnt3和DII4。将干细胞与潘氏细胞共培养可以显著改善类器官的形成。体内潘氏细胞缺失导致Lgr5干细胞丢失。因此,潘氏细胞通过分泌杀菌产物以及提供必需的Niche信号因子,充当干细胞的多功能守护者。

 2009
2009该研究首次建立肠类器官。单个隐窝经历多次裂变,产生绒毛样上皮结构域,涵盖所有分化细胞类型。单个Lgr5干细胞即可形成隐窝-绒毛类器官,并保留干细胞层级结构。因此得出结论,肠道隐窝-绒毛是自组织结构,可以在缺失非上皮细胞Niche的情况下由单个干细胞产生。


