

06.12 2025
引言
类器官技术与应用在近几年来发展迅猛,作为一种体外模型,与传统的体外单层细胞培养相比,类器官从形态、功能、基因、药物作用等方面与体内更加相似,从而获得更精准实验结果。同时,类器官因其可以进行长期传代扩增为样本库的建立提供了便利。
蛋白质组学技术通过系统性分析生物样本中蛋白质的表达水平、修饰状态及相互作用网络,能够全面揭示药物作用机制、探索潜在药物靶点等。但受限于临床样本获取难度大、体外模型蛋白质表达失真等瓶颈,制约了其广泛的应用。
基于体外类器官模型的生物活库可以实现对多种组织来源类器官的体外培养、低温保藏和复苏后再利用,仍具有遗传和表型方面的稳定性。2025年4月,FDA正式宣布将逐步淘汰传统动物模型等实验工具,转而鼓励采用类器官和器官芯片等新兴替代技术进行药物安全性测试,奠定了类器官这种新型实验模型在新药研发中的地位。
类器官+蛋白质组学或成顶刊标配!!!
虽然类器官技术已广泛应用于多个领域,但将其与蛋白质组学技术结合的研究仍处于起步阶段,近10年类器官相关研究仅3%整合了蛋白质组学。当前类器官+蛋白质组学的研究相对稀缺,竞争尚不激烈,其次,相关文章质量高,易于冲击高分:已有的相关研究如发表于Nature, Cell, Science Translational Medicine等期刊的文章,表明这一方向具备发表重磅论文的潜力。
1. 类器官一致性评价
2025年2月,挪威科技大学Chun-Mei Zhao教授团队在期刊Scientific Data(IF=5.8)在线发表题为:Proteomics profiling of research models for studying pancreatic ductal adenocarcinoma的高水平研究论文。通过蛋白质组学分析比较了类器官与原始样本(包括小鼠和人类的胰腺癌(PDAC)细胞、球体、类器官和组织)之间的相似性和差异性。结果表明,类器官在蛋白质表达、形态和功能上与原始肿瘤组织相似,能模拟化疗耐药性、高增殖和低凋亡等特性。但类器官在某些蛋白质表达上存在差异,可能与培养环境和缺乏完整肿瘤微环境有关。尽管如此,类器官仍是研究PDAC的重要模型,但需注意这些差异,并通过优化培养条件和结合其他模型提高研究价值。

2. 蛋白质组学助力类器官药物筛选与评价
复旦大学附属金山医院肿瘤中心高强教授团队的研究成果“Pharmaco-proteogenomic characterization of liver cancer organoids for precision oncology”发表在在国际权威生物学杂志Science Translational Medicine (IF=19.17)。本研究中,建立了65例患者来源的肝癌类器官生物库(LICOB),通过多组学分析(包括基因组、表观基因组、转录组和蛋白质组分析)确定各种肝癌类型的组织学和分子特征。利用蛋白质基因组分析确定了与患者预后相关的增殖和代谢类器官亚型。筛选了一系列临床使用或研发中的药物,通过对 LICOB 药物蛋白质组学数据的综合分析,研究确定了与药物反应相关的分子特征,并预测了个性化患者治疗的潜在药物组合,并在体外类器官模型、类器官移植瘤模型(PDOX)和患者来源移植瘤(PDX)模型中均得到了验证。

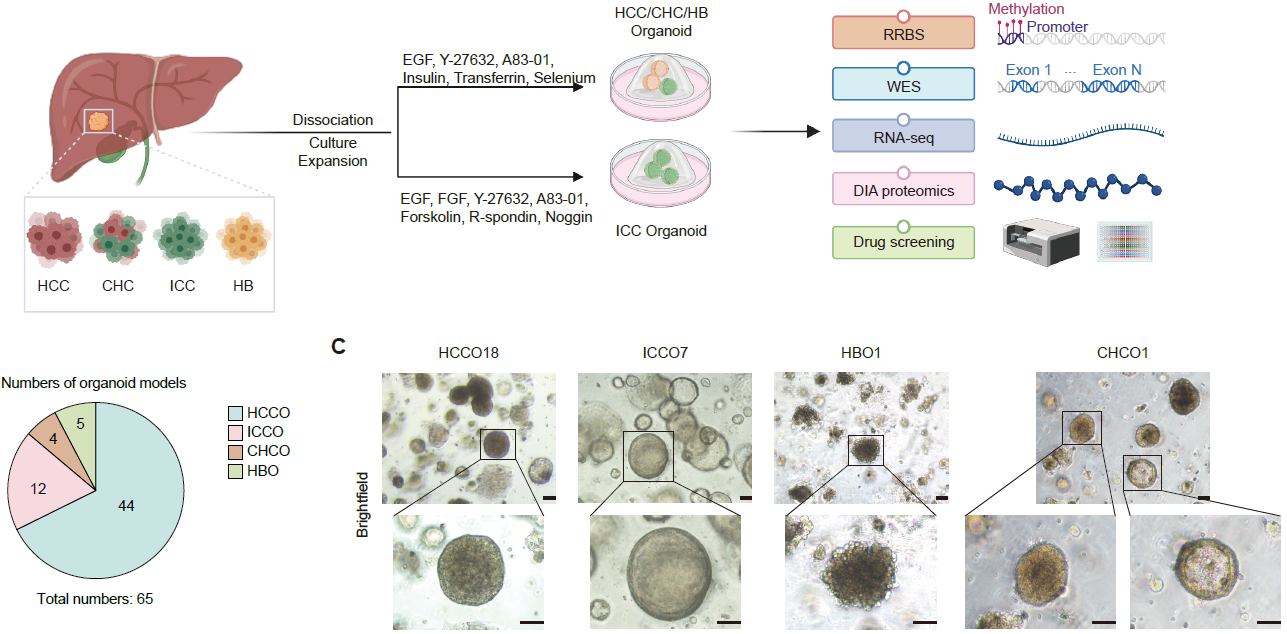
Hans Clevers院士(丹望医疗联合创始人)以及丹望医疗在本项研究的类器官相关领域给予了技术和科研支持。Hans Clevers教授是丹望医疗的联合创始人之一,丹望医疗作为国内领先的专注类器官模型和芯片技术的平台型公司,依托行业领先的技术优势,在类器官相关领域的科研服务、药敏检测及药物研发服务等方面取得突出成就。
详情点击https://mp.weixin.qq.com/s/EJmHrcWaVb_EBH5G_HzQ_g
3.分子分型&个体化精准药筛
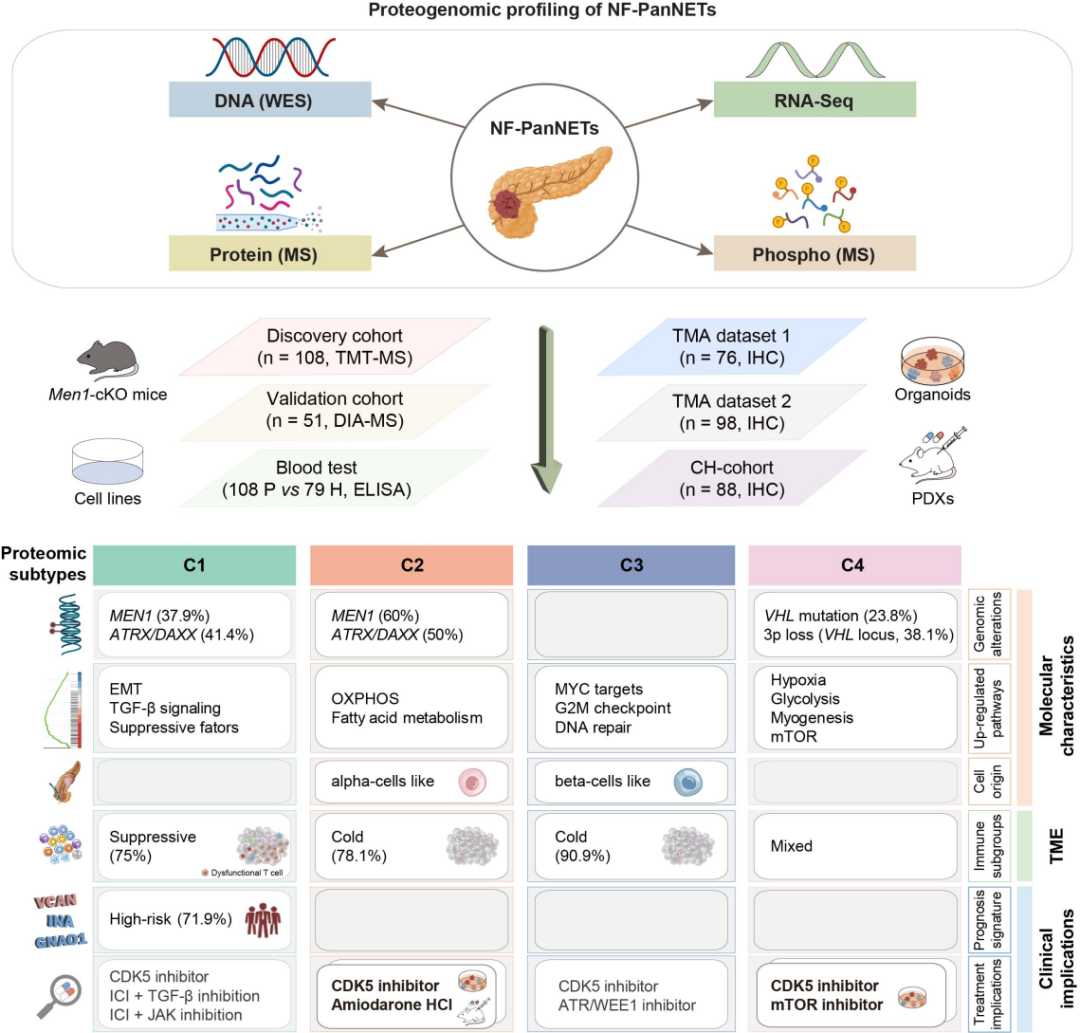
2025年4月4日,吉林大学樊钟琦团队在Journal of Hepatology(IF=26.8)在线发表题为“Cisplatin-induced Disruption of Mitochondrial Divisome Leads to Enhanced Cisplatin Resistance in Cholangiocarcinoma”的研究论文,突破性地提出分子分型框架、预后模型和靶向-免疫治疗新策略,为胰腺神经内分泌瘤的精准诊疗提供了重要依据。通过蛋白质组学特征聚类,将NF-PanNET患者划分为四个分子亚型,为临床治疗提供了的精准路线。利用PDO开展了药物筛选,并利用PDX进行验证,证实CDK5抑制剂对肿瘤生长的抑制作用。

4. 类器官+蛋白质组学助力疾病机制研究
2025年2月意大利萨勒诺大学Federica Papaccio等在期刊J Exp Clin Cancer Res
(IF=11.4)发表题为Decoding chromosomal instability insights in CRC by integrating omics and patient-derived organoids的高水平研究论文。本研究中通过整合多组学数据和患者来源的类器官(PDOs)来揭秘染色体不稳定性(CIN)的机制。分析评估PDOs及其原始转移性CRC(mCRC)组织的CIN水平。后续整合PDOs的RNA测序和蛋白质组学数据,构建了功能的相互作用网络,并识别了其中存在CIN中显著失调的过程。通过蛋白质组与加权基因组不稳定性指数(wGII)的Pearson相关性分析,使用功能基因组数据库和患者组织数据集进行验证,筛选出高置信度的CIN特征。研究证明PDO重现了独立组织队列中的基因组、转录组和蛋白质组CIN特征。
新品发布:类器官蛋白质组学一站式解决方案
近日,丹望医疗与青莲百奥达成战略合作,推出“类器官+蛋白质组学”的一站式服务。帮助各位研究人员摆脱样本难获取,方案难形成等难题,在类器官模型构建、药效药靶等各类研究中快人一步。
1. 类器官药效药靶筛选(Organoid+LiP-MS)
新药研发成本不断增加,从实验室到临床的成功率不足90%,通常是由于缺乏适当的、生理学相关的临床前筛选模型。在寻找新靶点的过程中,从蛋白质及其相互作用网络的层面对生物样本进行评估是必要的。类器官给药条件下筛选药物靶点,同时提供药物暴露后引起的生理/病理变化(蛋白表达变化),以阐明药物作用的分子机制。
2. 基于蛋白质组学的类器官模型一致性评价
构建类器官模型,结合高通量质谱技术,建立“类器官(库)-来源组织-蛋白质组”联动的模型评价体系。


